Глава V
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
§ 17. Теоретические основы
Принцип действия.
Гальванические элементы — химические источники электрической энергии, получившие широкое распространение во многих отраслях народного хозяйства. Во время разряда в гальваническом элементе происходит необратимый процесс преобразования химической энергии в электрическую, расходуются его активные вещества. Поэтому разряженный гальванический элемент приходит в негодность.
Гальванический элемент любого типа состоит из двух разнородных электродов (проводников первого рода), разделенных слоем электролита. Между этими электродами возникает разность потенциалов, которая зависит от материала электрода и состава электролита.
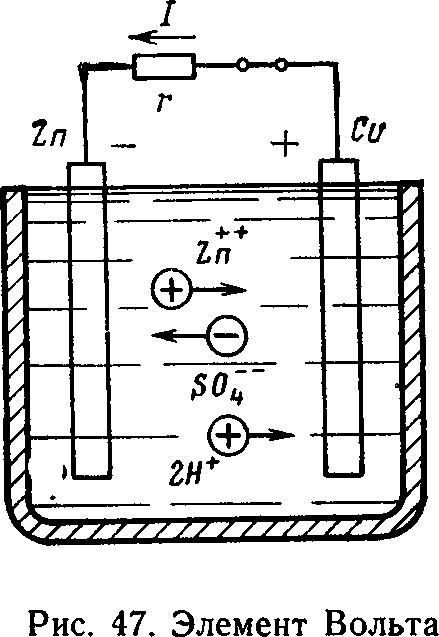
Сущность электрохимических процессов, возникающих в гальванических элементах, поясним на примере работы элемента Вольта (рис. 47), который состоит из сосуда с водным раствором серной кислоты и двух электродов: цинкового и медного. Цинковый электрод в электролите растворяется. Под действием химических сил в электролит переходят ионы цинка Ζη+. Ионы, соединяясь с отрицательными ионами кислотного остатка SO4, образуют молекулы цинкового купороса ZnSO4. При этом нарушается электрическая нейтральность электролита — он заряжается положительно. Свободные валентные электроны цинка остаются на электроде, и он приобретает отрицательный заряд.
В области соприкосновения цинкового электрода с электролитом образуется электрическое поле. Силы электрического поля направлены противоположно химическим силам, т. е. препятствуют растворению цинка. Если цепь разомкнута, то химические силы уравновешиваются силами электрического поля и процесс растворения цинка быстро прекращается. Между цинковым электродом и электролитом возникает определенная разность потенциалов, которая называется электродным потенциалом металла. Электродный потенциал цинка Е—0,76 В. Медный электрод нейтрализует часть ионов водорода электролита, отдавая им свободные электроны. Поэтому он получает положительный потенциал Е = +0,34 В. Следовательно, э. д. с. элемента Вольта Е = EZ1 — EZn 0,34 — (—0,76) = 1,1 В.
При замыкании внешней цепи валентные электроны цинка начнут перемещаться по проводнику г к медному электроду. Электрическое поле между цинковым электродом и электролитом ослабится, нарушится равновесие электрических и химических сил. Под действием последних возобновится процесс растворения цинка, перемещения ионов цинка и водорода к медному электроду, а ионов кислотного остатка — к цинковому.
Э. д. с. многих гальванических элементов сравнительно невелика: 1,2—1,7 В. Для получения больших напряжений гальванические элементы соединяют последовательно.
Явление поляризации.
Во время работы элемента происходит не прерывный процесс растворения отрицательного электрода, а к положительному электроду из электролита подходят ионы водорода, которые разряжаются на нем. Молекулы водорода на положительном электроде образуют непроводящий слой. Это явление называется поляризацией элемента. В результате поляризации увеличивается внутреннее сопротивление элемента и снижается его напряжение.
Для устранения поляризации в состав элемента вводят деполяризаторы — вещества, богатые кислородом, например перекись марганца. Деполяризаторы превращают водород в воду и освобождают положительный электрод от непроводящего слоя водорода.
Емкость и саморазряд.
![]()
Количество электричества, которое можно получить от элемента во время его разряда, называется его емкостью. Емкость измеряется в ампер-часах и определяется по формуле
Емкость гальванического элемента зависит от количества заложенных в него активных веществ, разрядного тока, режима разряда, температуры электролита и времени хранения. С увеличением разрядного тока ухудшается процесс деполяризации и активные вещества, заложенные в элемент, используются не полностью. В результате снижается емкость элемента. Перерывы разрядного тока улучшают процесс деполяризации и способствуют увеличению емкости. С увеличением температуры электролита химические процессы в элементах протекают более интенсивно и емкость элементов возрастает. При слишком высоких температурах происходит высыхание электролита и снижение емкости.
Даже при отключенной нагрузке в элементах происходит саморазряд, т. е. бесполезный расход его активных веществ. Саморазряд элемента вызывается несовершенством изоляции между электродами и образованием на отрицательном электроде местных гальванических нар в местах вкраплений в электрод посторонних примесей. Саморазряд увеличивается
при установке элемента в сыром месте и при загрязнении его пылью и грязью.
На каждом элементе указывается номинальная емкость, которая соответствует определенному, указанному заводом режиму разряда. Фактическая емкость элемента зависит от условий разряда и обычно отличается от номинальной емкости.
Существенным преимуществом всех гальванических элементов является их портативность, простота в эксплуатации и постоянная готовность к действию. Однако область их применения ограничивается невозможностью повторного заряда, сравнительно высоким внутренним сопротивлением и малым сроком хранения.
§ 18. Марганцово-цинковые и воздушно-марганцово-цинковые элементы
Для электропитания портативных устройств связи, электроизмерительных приборов, некоторых устройств сигнализации применяются марганцово-цинковые (МЦ) и воздушно-марганцово-цинковые (ВМЦ) элементы и батареи. Они выпускаются стаканчиковой (круглой или прямоугольной) формы или галетно-пленочной конструкции на емкости от долей ампер-часа до десятков ампер-часов.
Галетные элементы удобны для последовательного соединения, чтобы получить более высокие напряжения. Для этого их накладывают друг на друга так, чтобы положительный электрод одного элемента плотно соприкасался с отрицательным электродом следующего элемента .
Положительным электродом марганцово-цинковых элементов является агломерат, состоящий из смеси двуокиси марганца и графита, пропитанных раствором нашатыря, отрицательным — металлический цинк. В качестве электролита используется раствор хлористого аммония в виде пасты.
В сухих элементах системы ВМЦ в состав агломерата, кроме перекиси марганца и графита, добавляется активированный уголь, который способен адсорбировать (поглощать) из воздуха кислород. Поэтому в элементах ВМЦ деполяризация происходит более интенсивно, чем в элементах системы МЦ. При одинаковых наружных размерах элементы ВМЦ имеют почти в 2 раза большую емкость, чем элементы МЦ. Газовая камера элементов ВМЦ сообщается с наружным воздухом через специальное отверстие. У неработающих элементов для предохранения агломерата от высыхания эти отверстия должны быть закрыты пробками. Во время работы пробки следует открыть.
Положительные свойства элементов ВМЦ проявляются в том случае, если их разрядный ток не превышает максимально допустимого значения.
При перегрузке элементы ВМЦ теряют часть емкости, так как количество поглощаемого из воздуха кислорода становится недостаточным для нормальной деполяризации.
Элементы систем МЦ и ВМЦ имеют сравнительно простую технологию производства, низкую стоимость. Однако область их применения ограничивается относительно малой удельной энергией, резким снижением напряжения по мере разряда элемента (с 1,5 В до 0,9 В) н недостаточно полным использованием активных веществ.
Отмеченные недостатки значительно снижены в новых элементах, в которых улучшен состав электролита, применены новые материалы, использована новая технология производства.
Промышленность выпускает как отдельные элементы систем МЦ и ВМЦ, так и батареи, состоящие из ряда элементов, соединенных последовательно и заключенных в общий футляр. В зависимости от работоспособности при различных температурных условиях они подразделяются на летние (Л), холодостойкие (X) и универсальные (У).
§ 19. Топливные элементы
Топливные элементы относятся к числу химических источников электрической энергии. В качестве активных веществ, вступающих в химическую реакцию, в топливных элементах используется твердое, жидкое или газообразное топливо (древесный уголь, нефтепродукты, спирты, водород и т. д.).
Эти активные вещества хранятся отдельно от топливного элемента в особых хранилищах и поступают к электродам элемента лишь во время отдачи им электрической энергии. Электроды топливного элемента в реакциях активно не участвуют и в процессе работы не разрушаются. Поэтому топливные элементы обеспечивают непосредственное преобразование химической энергии в электрическую очень длительное время, пока идет подача активных веществ к его электродам.
Батарея топливных элементов с вспомогательными устройствами (резервуарами для хранения топлива, системами для подвода топлива, отвода продуктов реакции, регулирования температуры и давления) образует электрический генератор.
Простейший водородно-кислородный топливный элемент (рис. 48) состоит из положительного 1 и отрицательного 3 электродов, погруженных в щелочной электролит 2. Активным материалом положительного электрода является кислород О2, а отрицательного электрода — водород Н2. Они подаются к электродам через пористые трубки. Водород вступает в соединение с ионами гидроксила электролита
![]()
В результате образуется вода и свободные электроны (е — заряд электрона).
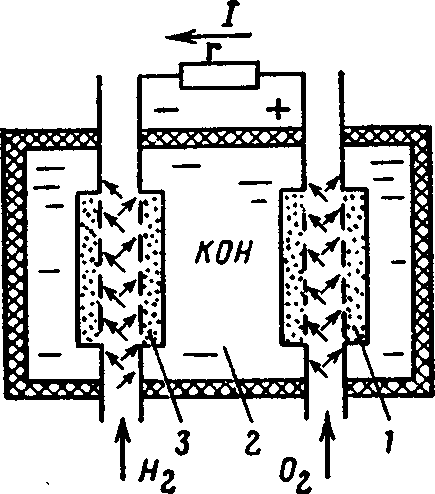
Рис. 48. Схематическое устройство водородно-кислородного топливного элемента
С водородного электрода свободные электроны перемещаются к кислородному электроду через нагрузку r. В пористом электроде 1 кислород вступает в реакцию с водой электролита, образуя ионы гидроксильного остатка![]()
В результате в замкнутой цепи возникает электрический ток. Расходы воды H2О в элементе восполняет водород, а расход гидроксила ОН — кислород. Рассмотренный химический процесс противоположен процессу электролитического разложения воды, где при пропускании тока через подкисленную воду образуется кислород и водород. Э.д.с. одного такого элемента равна 1,23 В, к.п.д. 83 %.
В настоящее время создано несколько вариантов топливных элементов, отличающихся друг от друга конструкцией, видом топлива и температурой горения. Все они имеют довольно сложную конструкцию, высокую стоимость. Большая работа, проводимая но усовершенствованию топливных элементов, обусловлена широкой перспективой применения этих элементов во многих отраслях народного хозяйства.
Мощные и экономичные топливные элементы могут быть использованы в автомобильном и железнодорожном транспорте, в качестве автономных источников электрической энергии различных предприятий. Применение топливных элементов в автомобилях создаст эксплуатационные удобства, снизит загрязненность воздуха выхлопными газами и дымом, уменьшит уровень шума. В электропитающих установках связи топливные элементы могут заменить резервные источники электрической энергии — аккумуляторные батареи и резервные электростанции.
